01
摘要

聚异戊二烯橡胶(Poly(cis-1,4-isoprene)是天然橡胶的主要成分,由顺式构型的-CH2-C(CH3)=CH-CH2-重复单元组成。为了提高橡胶产品的弹性和耐久性,天然橡胶的线性聚异戊二烯链通过硫桥以共价交联的方式进行硫化,形成硫化聚异戊二烯橡胶(Vulcanized poly(cis-1,4-isoprene)rubber, vPR)。vPR广泛应用于汽车轮胎和一般橡胶制品制造,全球消费量已达约1390万吨/年。尤其在COVID-19流行期间,一次性医用手套的大量需求导致vPR产品消费量急剧增长约10%。vPR废料丢弃到自然环境中会导致严重环境污染,但现有的填埋、焚烧和再利用等处理方法都不够环保。因此,探索更可持续的橡胶废物处理方法迫在眉睫。
微生物降解橡胶成为一种环保的替代方案。已发现几种微生物能够通过分泌橡胶氧合酶(Lcp、RoxA和RoxB)、漆酶或过氧化物酶来裂解顺式-1,4-异戊二烯链的双键,从而降解非硫化聚异戊二烯橡胶。本研究首次发现一种名为BIT-H3的不动杆菌,能以硫化聚异戊二烯为唯一碳源生长,通过对培养后的vPR理化性质变化分析及BIT-H3菌株的基因组和转录组分析,提出BIT-H3菌株的vPR生物降解途径,为开发硫化橡胶废物生物降解方法提供新的可能。
1. vPR降解菌株BIT-H3的筛选
这项研究利用黄粉虫肠道内容物作为接种物,通过使用硫化聚异戊二烯作为主要碳源进行生长,获得了一组微生物富集物。通过在LB琼脂平板上进行限制稀释,从这组富集物中成功分离出六种不同种类的细菌菌株。随后,在MSM培养基中,以硫化聚异戊二烯为主要碳源进行生长,对这些菌株进行了初步筛选。经过十周的孵育后,发现只有一种菌株(命名为菌株BIT-H3)表现出明显的生长。因此,菌株BIT-H3被选为具有潜在降解硫化聚异戊二烯能力的微生物进行进一步研究。根据菌株BIT-H3的形态特征和16S rDNA测序结果,可以确定该菌株属于不动杆菌属,因此提议将其命名为不动杆菌属BIT-H3种。
图1菌株BIT-H3的显微照片及分类鉴定。(a)应变BIT-H3扫描电镜图;(b)应变BIT-H3的透射电镜图;(c)基于菌株BIT-H3及其近缘型种16S rRNA基因序列的邻接系统发育树。基于1000个重复的引导值以百分比表示。以Iacunata Moraxella ATCC 17967T的16S rRNA基因序列作为外群。
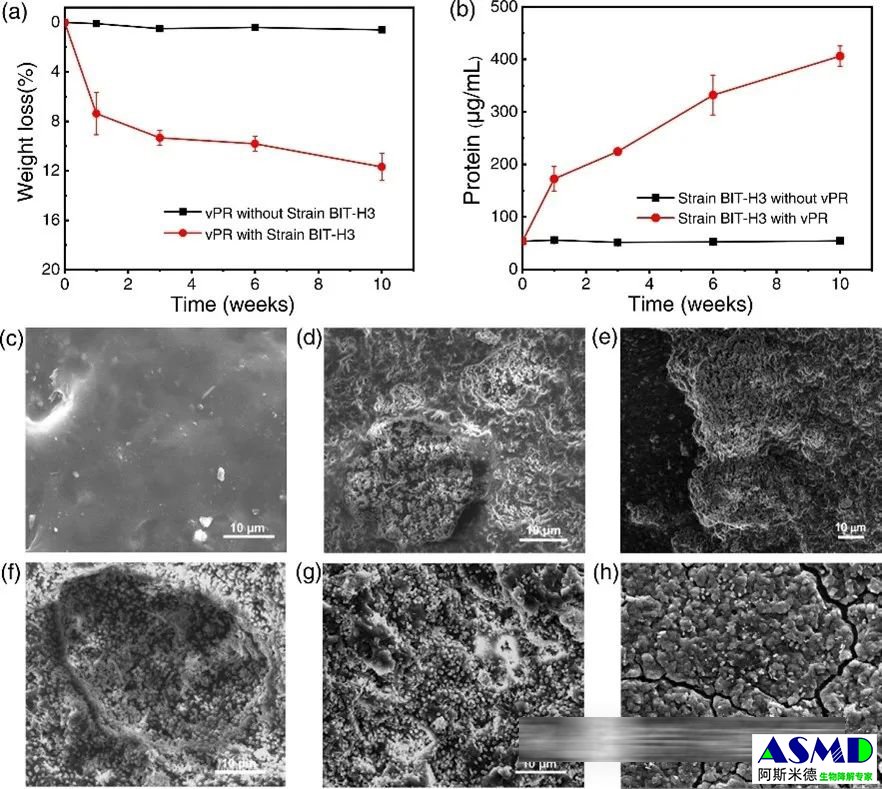
图2b展示了菌株BIT-H3在有无硫化聚异戊二烯作为主要碳源下的生长蛋白生成过程。当菌株BIT-H3在以硫化聚异戊二烯为唯一碳源的MSM培养基中培养时,培养物的蛋白浓度在十周培养后增加到406±19μg/mL。相比之下,在不添加硫化聚异戊二烯和其他有机营养物质的对照培养物中,菌株BIT-H3的蛋白浓度在整个培养时间内保持在较低水平(50μg/mL)。基于蛋白产量和重量损失的结果,菌株BIT-H3以硫化聚异戊二烯碎片作为唯一碳源培养的蛋白产量估计为0.67±0.01g蛋白/g橡胶碎片。这表明菌株BIT-H3能够将硫化聚异戊二烯作为碳源用于蛋白合成。
此外,通过扫描电子显微镜观察菌株BIT-H3在硫化聚异戊二烯碎片上的生长和降解能力。如图2c所示,未接种的培养物表面光滑,没有缺陷。相比之下,接种了菌株BIT-H3的培养物表面,菌株BIT-H3的细胞侵入硫化聚异戊二烯碎片中并形成多个菌落坑(直径约10~20μm)。图2d至图2h分别表示1、2、3、6、10周的菌坑变化:经过十周的培养,凸起结构形成大量小颗粒状突起,并出现明显的裂纹(图2h)。这些观察结果明确表明,菌株BIT-H3不仅能够在硫化聚异戊二烯碎片表面粘附生长,还能导致其显著分解。
3. 应变BIT-H3对vPR的解交联
菌株BIT-H3降解vPR的能力进一步通过检测接种有或没有菌株BIT-H3后剩余vPR的力学性能和化学结构变化进行验证。
首先,对有或没有接种菌株BIT-H3的vPR片进行拉伸强度测试,以确定力学性能的变化。如图3a所示,接种菌株BIT-H3的样品拉伸强度从78.2±4.2 MPa急剧下降到36.6±1.2 MPa,最大拉伸强度损失率达到约53.2%。相比之下,未接种的培养物的拉伸强度在十周的孵育时间内几乎没有变化。
图3.菌株BIT-H3降解vPR的力学性能和化学结构变化。(a)十周内,存在或不存在菌株BIT-H3时vPR的拉伸强度变化(平均值±SD,n=3);(b)十周内,存在或不存在菌株BIT-H3时vPR的交联密度变化(平均值±SD,n=3);(c)十周内,由菌株BIT-H3降解的vPR的溶胶分数与相对交联密度的关系。vi和vf是降解前后的vPR交联密度。实线或虚线根据Horikx方程(SI,M1)绘制,分别对应交联或聚合物主链断裂的情况。实线和虚线之间的区域对应于交联和聚合物主链均断裂的情况;(d)无菌对照与十周后由菌株BIT-H3降解的vPR的FTIR光谱;(e)无菌对照与十周后由菌株BIT-H3降解的vPR的碳K边XANES光谱;(f) 无菌对照与菌株BIT-H3降解的vPR在10周后的硫k边XANES光谱。
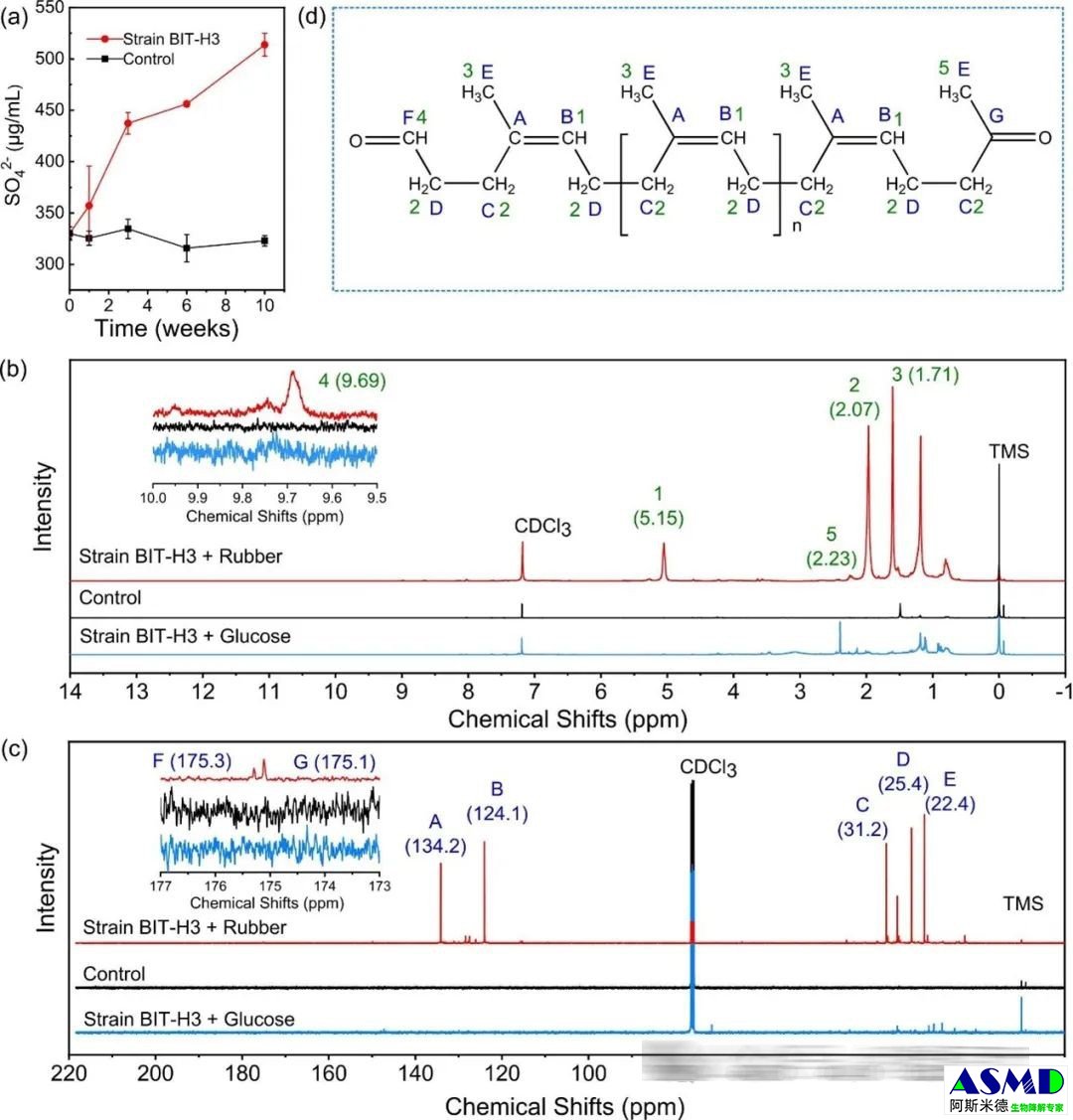
5. 脱硫酶和橡胶加氧酶编码基因的鉴定和转录
已知微生物脱硫途径,也称为4S途径,由dsz操纵子编码的DszA、DszB和DszC三种酶催化。同时,Lcp、RoxA和RoxB三种橡胶氧合酶以及漆酶和过氧化物酶已被报道能够切割聚(顺-1,4-异戊二烯)链中的双键。为了鉴定与vPR中硫桥和聚合物主链氧化断裂相关的酶的编码基因的同源基因,对菌株BIT-H3基因组进行了测序和功能分析。在菌株BIT-H3基因组中发现了由三个开放阅读框(ORF)组成的dsz-样操纵子。在这个dsz-样操纵子中,第一个ORF是dszA,与Rhodococcus erythropolis XP中的DszA有31.1%的氨基酸(aa)一致性;第二个和第三个ORF分别命名为dszC1和dszC2,与Rhodococcus erythropolis XP中的DszC有26.3%和22.3%的aa一致性。dszC1和dszC2之间的aa一致性为38.8%。该dsz-样操纵子缺少编码DBT-硫酸盐脱氢酶的DszB基因,并且在菌株BIT-H3基因组中未发现其他DszB同源基因。此外,从菌株BIT-H3基因组中恢复了编码漆酶样酶(Laccase 2147)和其他编码过氧化物酶样酶(Peroxidase 1232)的基因,虽没有在基因组中找到已表征的三种橡胶氧合酶Lcp、RoxA和RoxB的同源基因,但Laccase 2147和Peroxidase 1232都携带Sec途径介导的胞外定位信号肽。
为了评估这些基因在菌株BIT-H3降解vPR过程中的作用,对上述五个功能基因的转录表达进行了检测。从图5a中可以看出,在vPR上生长的细胞中,dszA(1425bp)、dszC1(1224bp)、dszC2(1203bp)、Laccase2147(1293bp)和Peroxidase1232(1203bp)的PCR产物呈现出明显的条带,而在葡萄糖上生长的细胞中则没有。相比之下,在葡萄糖或vPR上生长的细胞中,16S rRNA基因的PCR产物都出现了。这表明:在vPR存在的情况下,这五个功能基因dszA、dszC1、dszC2、Laccase2147和Peroxidase1232也被转录。没有进行逆转录反应步骤的对照RNA样本中则没有PCR产物,这表明RT-PCR产物(cDNA的PCR产物)不是来自污染的DNA(图5a)。在葡萄糖之外的vPR存在的情况下,上述五个功能基因的显著转录表明这些基因参与了菌株BIT-H3对vPR的降解。
图5所示。菌株BIT-H3降解酶的表达及降解vPR的机制。(a)菌株BIT-H3中3个脱硫酶编码基因和2个橡胶加氧酶编码基因的转录水平。以vPR (R)或葡萄糖(G)为碳源培养的BIT-H3菌株5个基因mRNA的RT-PCR扩增。Lane 1为菌株BIT-H3基因组DNA直接扩增基因的对照PCR产物。Lane 2和Lane 4表示在没有RT的情况下,DNA酶处理的RNA样品扩增出的PCR产物,其中没有PCR产物表明RNA样品中没有DNA污染物。Lane 3和Lane 5为在rt存在下dna酶处理的RNA样品扩增的PCR产物。(b)基于化学结构变化、降解产物分析、基因组和转录分析的菌株BIT-H3降解vPR的途径。
04
结论
责任编辑:苏田源 崔志勇